原子结构化学键高考题,离子键共价键口诀
离子键共价键口诀
非金属元素,元素B的最高价氧化物的水合物及其简单的气态氢化物可以反应形成盐。 C是短时间内原子半径最大的元素。 L层中的电子数与D元素中的电子数之差等于B元素最外层中的电子数,元素的最高正价态和最低负价态的代数和E等于4。据此,回答以下问题(元素周期表中元素F的位置,C原子结构的示意图。(A和B两个元素可以形成18个电子)该分子的分子式为。(由A和氧形成的简单化合物的熔点比由A和E形成的简单化合物的熔点更高。原因是(C,D,F可以形成络合物CDF4,所含化合物的类型为化学键。 .
化学分子结构思维导图
不能充分利用元素原子结构的特性,性质和其他特性来推断元素在元素周期表中的位置。1使用元素的原子结构特性来确定元素在元素周期表中的位置(确定的周期的电子层数,周期数Pd,第二周期的二次外部电子数为2的元素除外;在第三或第四周期的A和A组中具有二次外部电子数为8的元素;最外面的电子数大于第二个外面的电子数。的元素必须位于第二个周期中。元素的阴离子的最外层电子数与二次外层电子数相同,且该元素位于第三周期。如果是阳离子,则相应的元素位于第四个周期中。,(主基团的确定等于或大于3的电子的最外层必须是主族元素。如果最外层具有1或2个电子,它可以是A或A族元素,也可以是零族,亚族或零族氦元素,具有相同电子层结构的粒子阴离子的相应元素具有相同的电子层结构
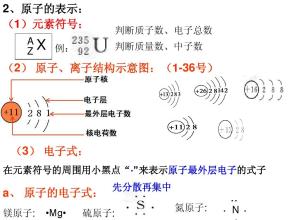
化学分子原子离子思维导图
因为非-元素X> W的金属性,所以A是正确的;因为非金属性W> Z,所以B是错误的;化合物YX(MgO)化学键是离子键,ZX2(SO2)和WX3(SO3)中的化学键是一个共价键,所以C是错误的;根据相同的周期性原子半径和相同的主族原子半径,我们知道D是正确的。
化学键的思维导图
个原子原子核外电子的组成,结构和排列(山东李章,2002年)。 2011)元素的原子结构决定了元素的性质和位置茶几。以下陈述是正确的()A。元素原子最外层的电子数量等于元素原子的最高价。B.在多电子原子中,电子在更靠近原子核的区域移动有更高的能量CP,S,Cl和获得电子的能力以及相应于最高价氧化物的水合物的酸度均按顺序增加。 D.在元素周期表中位于金属和非金属之间的边界附近的元素是过渡元素。分析F无正价,A错误。在多电子原子中,低能电子在靠近原子核的区域移动,B是错误的。 P,S和Cl的非金属性依次增加,电子的获得能力和最高价含氧酸(,,)的酸度依次增加,并且C是正确的;过渡元素是从第三列到第十二列的元素,包括七个子组和组Ⅷ,D是错误的。答案C.(江苏化学,2011年)以下相关化学术语是正确的()A.N2电子式N︙︙NB.S2结构图
氕氘氚的同位素写法
(全国通用)2019年版高考化学评论第19号讲课原子结构化学键课时作业,2019年全国高考化学审查,2019年高考化学审查材料,2019年高考化学审查,高考化学审查,高考化学审查,高考化学审查计划,如何审查高考化学,什么是最好的高考化学复习用书,一轮高考化学复习材料
化学键与分子结构
g,项目B是正确的?原子中子数为60,两者之差为20,C项误差;元素的相对原子质量是从该元素的各种自然同位素的相对原子质量和所占原子数的百分比计算出的平均值。因此,对应于14g钕元素的钕原子的量不是1mol。电子不是6摩尔,D项是错误的。

共价键口诀
个元素,N为Si元素,R为Cl元素。 AOF和Na离子的电子层结构相同。核电荷越大,离子半径越小,因此离子半径就是简单离子YXZ的半径,因此A是错误的;在结构中有离子键和共价键,在结构中只有离子键。因此,B是错误的。 CZ,M和R的高价氧化物所对应的水合物分别是NaOH,并且是两亲的,因此C是正确的。 DY,X和R的气态氢化物分别为H2O,HF,HCl,H2O,HF当分子之间存在氢键且相同物质的量时,水分子之间的氢键较强,沸点更高,沸点从大到大,所以D是正确的。选择C作为答案。 ,8A,B,C,D,E,F是短周期主族元素的6种,原子序数依次增加,A属于IA族。在
化学键知识点
年期间,相同主族元素的性质的渐进律表明原子半径为:As> P> C1,所以A是错误的;非金属:C1> Br> As,因此热稳定性HC1> HBr> AsH3,B是错误的;非金属的C1> S> As,所以还原As3> S2> C1,C是正确的;非金属S> P> As,因此最高价含氧酸>>,D的酸度是错误的。
化学键与晶体结构思维导图
(2012·江苏化学·T12)短周期元素X,Y,Z和W的原子序数依次增加。 X原子最外层的电子数是内层电子总数的三倍,Y原子最外层的电子数只有2个。Z元素可以制成半导体材料W和X属于同一个主要家庭以下陈述是正确的()
电子类型,是电子写作中的“四大误解”,元素属性比较中的常见错误,1对于主族元素,该元素的最高正价与主族相同序号,但氟没有正价,也没有氧气的最大正价,通常为零或负。 2错误的是,具有最高正价格和最低负价格的绝对值相同的元素只是A组的某些元素。A组H的最高正价格为1个价格,而最低负价格为1个价钱。 3根据与水合物相对应的元素氧化物的酸度和碱度的强度来判断元素的非金属性或金属性的强度时,它必须是氧化物含量最高的水合物。 4金属离子的氧化越强,相应金属的金属性越弱。同样,非金属离子的还原越强,相应的非金属非金属越弱。 ,无法准确确定元素的化合价。除了最外层电子的数量等于主族元素原子O和F以外,主族元素的最高正态价等于主族序数。非金属元素。
(2012·浙江高考·T9)X,Y和Z是原子序数增加的短周期元素。这三种元素的核外电子数之和等于Ca2 +的核外电子数。 X和Z各自获得一个电子。然后,形成稳定的稀有气体原子的电子层结构。下面的语句是正确的()
2. 本站客服在线时间【上午9点-晚9点】!如有链接无法下载、失效或广告,请联系客服处理,有奖励!
3. 如果您也有好的资源或教程,您可以投稿发布,成功分享后有站币奖励和额外收入!
玛丽圈 » 原子结构化学键高考题,离子键共价键口诀






