化学电池的高考题,化学高考题型总结
化学高考题型总结
测试问题分析:A.充电是一个电解池,阳极发生氧化反应,这是电子的损失和误差; B.充电是一个电解池,阳离子移动到阴极,这是错误的。 C.放电是负极的氧化反应,电子丢失,这是错误的。 D.一次电池中的正离子移至正电极,正确。
高考化学题库
所高中化学主要将热化学,电化学,化学反应速率和四种平衡知识整合在一起提出命题。考试的内容也更多,导致思考的角度更大,考试题的难度也更大。要求很高。编辑编辑了高中化学的主要知识点和解决问题的能力,希望对大家有所帮助。

化学高考题及答案解析
3Zn ++ 8H2O 3Zn(OH)2 + 2Fe(OH)3 + 4KOH以下陈述不正确是A。放电过程中的负反应是:Zn2e + 2OHZn(OH)2B。充电时的阳极反应为:Fe(OH)33e + 5OH + 4H2OC。当每3moL放电时,电子转移,正极被氧化。在放电过程中,通过
电池反应方程式
分析可提高正极附近溶液的碱度。将镁粉,铁粉和盐添加到水中,以形成电动电池装置。金属镁是负极。镁和水的反应是放热反应。原电池的形成可以加速化学反应。反应速率可以用原电池的原理来解释。 A不符合问题的含义;铁钝化后,会在金属表面形成致密的金属氧化物膜,以保护内部金属不被腐蚀。不能用原电池原理来解释。 B符合标题的含义;当纯锌与稀硫酸反应时,滴入少量溶液后,金属锌可与硫酸铜反应代替铜。 Zn,Cu和硫酸将形成电化装置,而Zn是负电极,这使得Zn与硫酸反应速度更快,可以用原电池的原理来解释,C不符合问题;镀层破损后,镀锌铁和潮湿的空气形成原电池,金属Zn为负极,Fe为正极,Fe被保护,镀锡铁由潮湿空气形成。在一次电池中,金属Fe为负极,Sn为正极。 Fe的腐蚀速度加快。镀锌铁比镀锡铁更耐用。可以用原电池的原理来解释。 D不符合问题的含义。
化学电池的工作原理
(2006年天津卷)中国第一个海洋电池以铝板为负电极,铂网为正电极,海水为电解质溶液,空气中的氧气与铝发生反应以产生电流。电池为:4Al + 3O2 + 6H2O = 4Al(OH)3,以下说法不正确的是()
化学高考题全国卷
测试题分析:A,氢被氧化,负极被氧化,因此电极a为负极,这是正确的;电极B和b是正电极,并且发生还原反应,这是错误的; C。一次电池是化学的可以转换为电能的装置是正确的; D。电池的工作原理本质上是氢的燃烧反应,所以总反应是2H2 + O2 = 2H2O。正确,答案是B.
高考化学题库及答案
电解原理在实际生产中具有重要地位,综合应用与精算结合l生产常出现在高考中。需要记住阴离子和阳离子的放电顺序和相应的电极反应,并在此基础上,掌握氯碱工业,电解,电镀的原理以及在电解过程中的相关性计算。已知
2018年化学高考试卷
:处于平衡状态的气体分压=气体的体积分数×系统的总压力,在T℃达到平衡,此时系统的总压力为p = 2MPa,则在T℃下反应的压力平衡常数Kp =;平衡后,如果温度保持不变,然后向容器中填充NO和CO2,则平衡将移动(填充“左”,“右”或“否”)。
高中化学电池
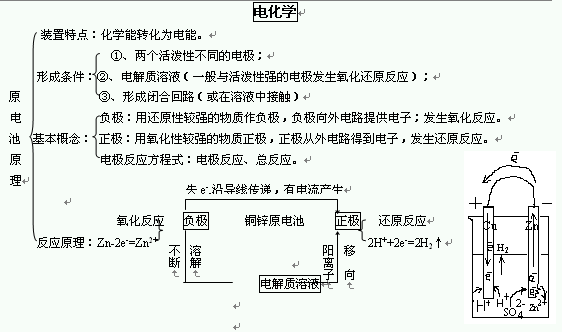
原电池的“原创”一词可以理解为原始社会。原始社会似乎没有电,这意味着没有电源。由于没有电源,因此它本身就成为电源,因此存在正负两点。电解池,以“电”一词开头,表示电源为,则有正极和负极,无需组成正极和负极,则只能有正极和负极。生产的。这样,将一次电池分为正极和负极,并将电解池分为正极和负极,这是显而易见的。
的突破方法:首先写下电极的反应物和产物,分析电子的得失,特别注意电极反应产生的物质是否与电解液中的离子发生反应;根据电解液的环境,通过减去和减去相应的阴离子和阳离子,该方法是满足电极反应式左右两侧电荷数的守恒,最后完成质量守恒。注意隐式反应,使用“正反应+负反应=总反应”来寻找另一个电极反应。相反,
放电会干扰外部电源,向阴极(原始原电池的负极)补充电子,使阴极材料发生还原反应,而阳极发生氧化反应,因此原本由电反应产生的物质被还原到反应之前的状态。这是将电能转换为化学能的过程。
(减少;温度升高时,反应①是放热反应,并且平衡向左移动,使系统中的CO量增加;反应是吸热反应,并且平衡向右移动总的结果是,随着温度升高,CO的转化率降低; P3> P2> P1;在相同温度下,因为反应①是气体分子数量减少的反应,加压有利于提高CO的转化率;并且该反应是气体分子数目不变的反应,CO的产生量不受压力的影响,因此当压力升高时,有益于碳O的转化率提高了
,这是电解质溶液中阴离子和阳离子运动的问题,或者回到了上面讨论的电流问题,电流是方向。 n正电荷运动。在溶液中,它是阳离子的运动方向。中间阳离子的移动方向必须与外部电路(即,导线上)中电流的方向相同(即,接收器在电路中为顺时针方向,并且其流动方向必须为顺时针方向) ,该电路可以称为电路。因此,根据先前的分析,当前方向是从正到负。我们可以将整个电路想象为一场接力赛。正电荷从正极的底部一直流到负极的底部。然后溶液中的阳离子消失了。它的方向与电流流动的方向相同,然后阳离子在哪里流动,到达正电极底部的正电荷开始的位置,从而使继电器竞赛结束。因此溶液中的阳离子移动到正极,而阴离子移动到负极。
(2004年全国16个)X,Y,Z和M代表四个金属元素。当金属X和Z通过导线连接并置于稀硫酸中时,X会溶解,氢会在Z电极上释放;如果电解时Y2 +和Z2 +共存,则溶液低时,Y首先析出。还已知M2 +比Y2 +更具氧化性。这四种金属的活性从强到弱的顺序为()
。标题:锂被称为“金属味精”,认为带有正极材料的锂离子电池已被广泛用作便携式电源。在工业上,β锂辉石(主要成分还含有FeO,MgO,CaO和其他杂质)通常被用作生产金属锂的原料。过程之一如下:
2. 本站客服在线时间【上午9点-晚9点】!如有链接无法下载、失效或广告,请联系客服处理,有奖励!
3. 如果您也有好的资源或教程,您可以投稿发布,成功分享后有站币奖励和额外收入!
玛丽圈 » 化学电池的高考题,化学高考题型总结






