化学平衡高考习题
化学平衡问题是高考化学的必需测试点,它主要检查催化剂,浓度,温度,压力等对化学平衡运动,化学反应速率和化学平衡常数的特定影响。另外,将涉及转化率和平衡常数的计算。因此,让我们简要总结一下相关的知识点。
高考化学2016第二轮回顾化学平衡常数知识点摘要_高考化学知识点_精品学网平衡常数通常包括浓度平衡常数和压力平衡常数。与反应物反应物浓度变化有关的化学平衡的基本计算:平衡浓度=转移至
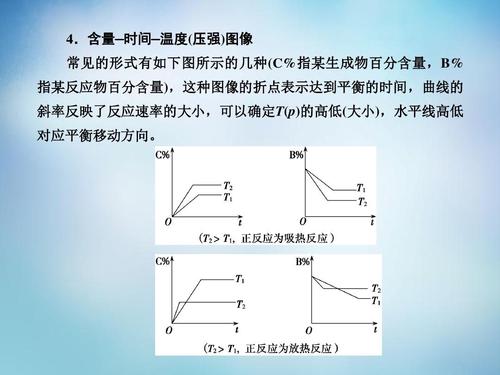
initial的初始浓度。2017高考化学备注高级三化学平衡测试地点摘要示例详细说明。高三是前高考个化学问题的必修内容,因此考生应更加注意此类问题并掌握相关知识点! Sanhao.com高中的化学老师组织了高三的化学平衡个知识点,具体如下。
化学反应是整个化学知识点学习过程中的重要内容。高中在线学校的化学老师向学生介绍了化学平衡高考个问题,学生应在后续学习过程中掌握这些问题。在普通的学习过程中,我们肯定需要消除化学平衡高考问题。然后,在本文中,“酷课”的老师将向学生详细介绍化学平衡高考问题的问题类型和解决问题的技能。
希望增加n()/ n(CO2),即使反应向前发展。当温度升高时,化学平衡向吸热反应的方向移动,即,平衡向反方向移动,n()/ n(CO2)减小;充入He(g)会增加系统压力,但每种物质的浓度不变,n()/ n(CO2)不变。从系统中分离出H2O(g),除去产物,反应向前进行,n()/ n(CO2)增加;重新填充,并保持恒定的体积该系统等效于增加压力并沿反应体积减小的方向移动。 n()/ n(CO2)增加。
化学平衡理论是中学化学的重要理论,也是高考测试中的热点和难点。在高考测验中,由于化学平衡测验题更好地检验了学生的思维和想象能力,逻辑推理能力和化学计算能力,因此受到命题主义者的青睐。如何回答这部分测试题?我认为学生应该在掌握基础知识的同时学习。使用以下三种解决问题的策略。简而言之,对化学平衡个综合问题的回答应有扎实的基础和独特的化学思想作为后盾。只有养成在解决问题的过程中进行深入思考和积累总结的习惯,才能不断提高解决问题的能力!

张专辑的主要内容是有关化学反应速率和化学平衡; =(51,51,51);(Q&A); / span的相关知识,包括与速度和平衡有关的概念的整理,图像问题的突破,过去五年中对高考个问题类型的详细解释,以了解有效的平衡思维。
的问题11是化学平衡的问题,涉及新教科书中新引入的化学平衡常数。对于转换率等概念,此问题有很多内容,包括化学平衡常数的概念和影响因素,以及外部条件对化学平衡常数的影响。根据标题提供的信息,反应是放热的。
(研究表明,使用同等质量的催化剂时,增加催化剂的比表面积可以提高化学反应速率。为了验证温度和催化剂的比表面积对催化剂的影响化学反应速率,一个学生设计了三组具有一定实验条件的实验下表的实验设计表中已经填写了
只谈论气体,因为气体的测试最多。首先,我们必须知道我们要寻找的数据必须是气体,然后公式中替代的是浓度而不是物质的量,但是如果整个过程是在恒定体积的条件下进行的,也可以用一定数量的气体代替在
反应达到平衡后,如果压力升高,则平衡将朝着降低气体前沿系数之和的方向移动,气体前沿系数之和是相同的可逆反应增加了压力,仅增加了正向和反向反应速率,但不影响转化率,即不影响平衡运动。
2005年10月3日,诺贝尔奖评审委员会向澳大利亚科学家巴里·马歇尔和罗宾·沃伦颁发了年度生理学或医学奖,以表彰他们发现了幽门螺杆菌及其在胃炎和胃炎等疾病中的作用。胃溃疡。以下有关幽门螺杆菌的陈述是正确的()
,表明反应平衡常数K(300°C)K(400°C)(填写“大于”或“小于”)。将HCl的初始浓度设为c0,并根据进料浓度比c(HCl):c(O2)= 1:1 K(400℃)=(列出计算公式)进行计算。根据化学计量比进料可以保持反应物的高转化率,同时减少产物分离的能量消耗。进料浓度比c(HCl):c(O2)太低分别高和高的不利影响。
运行现象。结论A.滴加溶液会产生白色沉淀。原始溶液使用干净的铂丝浸入溶液以进行火焰反应。火焰是黄色的。原始溶液包含Na +而不含K + C。和CC14一起摇匀,使下层溶液显示紫色。原始解决方案中有ID。滴加稀NaOH溶液。用
计算某种反应物的转化率时,将某一时刻的残留物质量除以反应前的物质量。该物质的量是直至某一时刻的物质转化率。当测量值是处于平衡状态的物质的量时,计算出的转化率就是平衡转化率。
请注意我们所说的“等待“有效平衡”不同于“完全相同的平衡状态”;“等效平衡”仅要求平衡混合物中每种成分的含量分数(或体积分数)对应于相等,平衡中的两个平衡状态有时完全相同,有时不相同。
(提示“请从使用过氧化氢的试剂的角度进行解释。方法”。通过常规学习,高温时H2O2不稳定,因此尽管高温能量加快了化学反应速率,但如果温度太高,则会引起H2O2的分解。 ,第
个问题(问题:“将pCP的初始浓度控制在298K或313K的实验温度下相同的常数(其他实验条件显示在t这句话中的信息可以解决表格第二栏中的问题。 “调查温度对降解反应速率的影响”,因此表格的这一行应填写“ 313、3、0、30”,第三行①进行比较以查找其他温度。浓度没有变化,并且pH值从3更改为10,因此第三行应填写“探索溶液的pH值对降解反应速率的影响。”
(合成氨反应N2(g)+ 3H2(g)2NH3( g),如果在恒定温度和压力条件下将氩气送入恒定系统,则平衡将移动(填写“左”,“右边”或“否”);催化剂反应的△H(填写“增加”) ,“减少”或“不变”)
在恒定温度和恒定体积的条件下,对于反应前后具有相同数量气体分子的可逆反应,进料是不同的,如果化学计量比可逆反应的数量转换为化学方程式同一侧的物质如果反应物(或产物)的比例与原始平衡相同,则两个平衡就等于平衡状态。在恒定温度和恒定体积下的分子数是恒定的。相同的数量和比例是等效的。
答案:(甲酸甲酯的还原范围是;甲酸甲酯的平均反应速率是(反应速率随着反应的进行逐渐增加,然后逐渐降低,然后保持不变;原因:随着反应的继续,浓度甲酸甲酯的浓度应开始增加,因此反应速率更大,然后随着反应的进行,甲酸甲酯的浓度将继续降低,反应速率继续降低,因此转化率逐渐降低。在密闭容器中,在A和B含量相同的情况下,随后的反应A(g)+ 2B(g)2C(g)达到平衡,转化率不会发生变化。如果混合气体中A和B的量之和等于C的量,则A的转化率是(????)①
混合气体密度容器中的化学反应速率:化学反应速率是物理用于测量化学反应速度的物理量。弱电解质电离平衡:在某些条件下(例如温度,浓度),当弱电解质分子电离时,离子形成的速率和溶液中离子结合形成弱电解质分子的速率






